2021-05-27
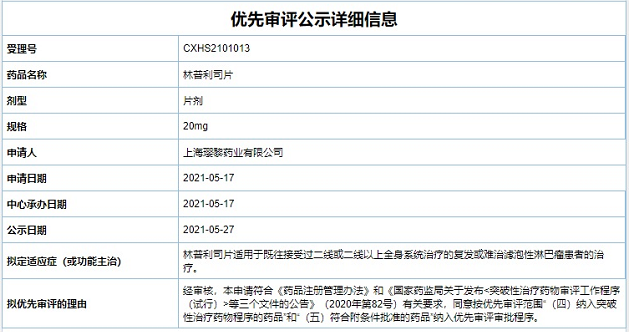
璎黎药业创新药林普利司片上市申请纳入拟优先审评名单
5月27日,上海璎黎药业有限公司自主研发的1类新药林普利司片(Linperlisib)上市申请符合突破性治疗药物审评工作程序的有关要求,中国国家药品监督管理局药品审评中心同意纳入优先审评审批程序并予以公示。本次在国内递交林普利司片的上市优先审评规格为:20mg,针对的适应症为复发/难治滤泡性淋巴瘤的治疗。
此次璎黎药业的林普利司片被纳入优先审评,意味着其审批速度有望加快,是继国家药品监督管理局受理林普利司片上市许可申请后取得的又一新进展。

林普利司是一种口服PI3Kδ抑制剂。2018年10月,林普利司片获得美国FDA颁发的两项孤儿药资格;2020年4月, 林普利司片获得美国FDA准许,在美国直接开展II期临床试验;2020年9月,林普利司片获NMPA突破性疗法认定;2021年3月,林普利司片用于治疗复发/难治滤泡性淋巴瘤2期注册临床试验完成;2021年5月,国家药品监督管理局正式受理林普利司片的NDA申请。

